Экстремальные состояния. Патофизиология боли. Патофизиология стресса. Патофизиология коматозных состояний
Страницы работы


Фрагмент текста работы
Экстремальные состояния (1)
1. Боль 2. Стресс 3. Кома
Определение понятия «боль»
Боль – это неприятное субъективное ощущение, обладающее в зависимости от его локализации и силы различной эмо-циональной окраской, сигнализирующее о повреждении или об угрозе существова-нию организма и мобилизующее системы его защиты, направленные на осознанное избегание действия вредоносного факто-ра и формирование неспецифических ре-акций, обеспечивающих это избегание.
* Компоненты боли (по: В.К.Решетняк и М.Л.Кукушкин)
перцептуальный компонент, позволяющий определить место повреждения (после поступления ноцицептивного сигнала в кору головного мозга)
эмоционально-аффективный компонент, формирующий не- приятное психоэмоциональное переживание вегетативный компонент, отражающий рефлектор-ные изменения работы внутренних органов и тонуса симпатоадреналовой системы
двигательный компонент, направленный на устранение дей-ствия повреждающих стимулов когнитивный компонент, формирующий субъективное отно-шение к испытываемой в данный момент боли на основании накопленного опыта
* Антиноцецептивная система мозга (по: В.К.Решетняк и М.Л.Кукушкин)
кора головного мозга
А-дельта и С-волокна (+)
ЛТ – латеральный таламус; МТ – медиальный таламус; ЦСВ – центральное серое вещество; ЯШ – ядра шва; ЗГ – задняя группа ядер таламуса; «+» — возбуждающие влияния; «-» — тормозные влия-ния.
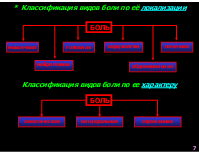
* Классификация видов боли по её локализации
кардиалгии почечная мышечная головная нейрогенная абдоминальная
Классификация видов боли по ее характеру
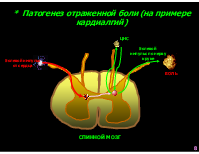
* Патогенез отраженной боли (на примере кардиалгий)
болевой импульс по нерву к руке
болевой импульс от сердца
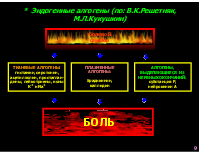
* Эндогенные алгогены (по: В.К.Решетняк, М.Л.Кукушкин)
ПЛАЗМЕННЫЕ АЛГОГЕНЫ: брадикинин, каллидин
ТКАНЕВЫЕ АЛГОГЕНЫ: гистамин, серотонин, ацетилхолин, простаглан- дины, лейкотриены, ионы К+ и Na+
АЛГОГЕНЫ, ВЫДЕЛЯЮЩИЕСЯ ИЗ НЕРВНЫХ ОКОНЧАНИЙ: субстанция Р, нейрокинин А
Определение понятия «стресс»
Стресс – это типовая (неспецифическая) реакция организма на чрезвычайный раздра-житель, в основе которой лежит активация гипоталамо – гипофизарно – надпочечниковой системы, и заключающаяся в такой пере-стройке деятельности организма, которая мог-ла бы обеспечить его оптимальную адаптацию к новым условиям функционирования, но соз-дающая в то же время основу для развития па-тологических состояний, связанных с наруше-нием регуляторных процессов.
* Стадии общего адаптационного синдрома (по Г.Селье)
ФАЗА ПРОТИВОШОКА: гипертония, гипертермия, активация ЦНС, уплотнение мембран, преобладание ассимиляции над диссимиляцией
ФАЗА ШОКА: гипотония, гипотермия, депрессия ЦНС, нарушения микро- циркуляции, пре- обладание дис- симиляции над ассимиляцией и др.
компенсация нарушенных функций и выздоровление
ослабление резервных возможностей организма, развитие стадии истощения и смерть
* Схема механизмов стрессовой реакции
АКТИВАЦИЯ ГИПОТАЛАМИЧЕСКИХ ЦЕНТРОВ
ВЫДЕЛЕНИЕ РИЛИЗИНГ – ФАКТОРОВ
СТИМУЛЯЦИЯ ВЫДЕЛЕНИЯ ГИПОФИЗОМ АКТГ
стимуляция выделения надпочечниками кортикоидов и адреналина
активация симпатической нервной системы и усиление секреции норадреналина
воздействие кортикоидов и катехоламинов на органы и ткани
изменение функции органов и систем в процессе их адаптации к чрезвычайному раздражителю
* Адаптивные эффекты стресс-реакции и превращение их в повреждающие эффекты (по М.Г.Пшенниковой)
увеличенная секреция медиаторов и гормонов
А Д А П Т А Ц И я
активация фер- ментов, свобод- но-радикально- го окисления, каналов ионного транспорта, ре- цепторов, фер- ментов
передача энергетических и структурных ресурсов в систему адаптации к данному стрессору
развитие «анаболической фазы» стресс- реакции: активация синтеза белков
увеличение кон- центрации каль- ция в клетке; активация функ- ции клетки
мобилизация энергетических и структурных ресурсов организма
нерегулируемый клеточный рост, дающий в соче- тании со стрес- сорным иммуно- дефицитом онко- генный эффект стресса
П О В Р Е Ж Д Е Н И е
перегрузка клеток кальцием и детер- гентное действие свободных жирных кислот, лизофосфолипидов, приводя- щее к повреждению клеточных мем- бран и нарушению структуры и функ- ции клеток
истощение энергетических ресурсов клеток
ишемическое повреждение «неработающих» органов
Взаимодействие стресс-системы и ГАМК-ергической системы (по Ф.З.Меерсону и М.Г.Пшенниковой)
активация стресс-системы активация НА-нейронов в ЦНС
активация гипоталамо- гипофизарно-адреналовой системы
глюкокортикоиды активация ГАМК-системы
ограничение секреции КРГ и других рилизинг-факторов гипоталамуса и секреции гипофизарных гормонов
ограничение высвобождения А и НА в ЦНС и других органах
ограничение стресс-реакции и ее повреждающих эффектов
* Патогенез первичного стрессорного повреждения сердца (по Ф.З. Меерсону и В.А.Фролову)
- ФАКТОРЫ ЗАЩИТЫ
- ОТ СТРЕССА:
- — медиаторы, блоки-
- рующие различные
- звенья стресс-реакции;
- мембранопротекторы;
- ингибиторы ПОЛ;
- блокаторы кальциевых
- каналов;
- ингибиторы протеаз;
- ингибиторы кальмоду-
- лина
повышение потребности миокарда в кислороде и нехватка О2
адсорбция катехоламинов миокардом
активация стресс-системы; стресс-реакция
катехоламиновый «удар» по сердцу
липидная триада: активация фосфолипаз; активация ПОЛ; детергентное действие жирных кислот
увеличение вхождения Ca2 в кардиомиоциты
истощение резервов гликогена
лабилизация мембран лизосом и выход их энзимов в цитоплазму
повреждение кардиомиоцитов и нарушение их энергетики
возникновение очаговых повреж- дений миокарда
* Роль клеточных и органных стресс-лимитирующих систем при стрессорном повреждении миокарда (по М.Г.Пшенниковой)
активация стресс-системы (гипоталамус, гипофиз, над-почечники, симпатическая нервная система и др.).
выработка стрессорных гормонов и медиаторов
повышение уровня NO
липидная триада; увеличение внеклеточного Ca++; свободные радикалы
антиадренергическое дей-ствие; коронародилатация; цитопротекторное дейст-вие; антитромботическое действие выработка БТШ
* Роль стресса в этиологии и патогенезе ИБС и инфаркта миокарда (по Ф.З.Меерсону и М.Г.Пшенниковой)
стрессорные повреждения печени, атерогенная дислипидемия
экзогенные факторы — эмоциональные ситуации окружающей среды инфаркт миокарда
аритмогенный эффект стресса, депрессия сократительной функции неишемизированных участков сердца
a — адреноергический и вазопресси- новый коронароспазм
констрикция коронарных сосудов вследствие гипервентиляции легких
накопление тромбоксана, уменьшение отношения простоциклин/тромбоксан, увеличение свертываемости крови, тромбоз
уменьшение резистентности миокарда к гипоксии и реоксигенации
общее увеличение сопротивления сосудов большого круга кровообращения, перегрузка сердца
эндогенные факторы – боль и страх смерти
уменьшение венозного тонуса, избыточное депонирование крови
* Патогенез стрессорного поражения желудочно-кишечного тракта (по М.Г.Пшенниковой)
гипоталамус стресс-система синее пятно
снижение моторики желудка
сакральные парасимпатические нейроны норадреналин
усиление моторики кишечника
ишемия слизистой оболочки желудка
хронические боли в желудочно-кишечном тракте
язвенное поражение желудка
* Взаимосвязь иммунной системы и стресс-системы: контур саморегуляции активности иммунной системы (по М.Г.Пшенниковой)
ИММУНО- КОМПЕТЕНТНЫЕ КЛЕТКИ
СП – синее пятно; АВ – аргинин-вазопрессин; Г – гипофиз; КРГ – кортикотропин-рилизинг-фактор; АКТГ – адренокортикотропный гормон
* Схема механизма подавления иммунореактивности при стрессе (по М.Г.Пшенниковой)
стресс-белки (белки теплового шока)
КРГ – кортикотропин-рилизинг- фактор; Г – гипофиз; НА – норадреналин; NPY – нейро-пептид «Y»; А – адреналин; ГК – глюкокортикоиды; СНС – симпатическая нервная система; IL-1 – интерлейкин 1; АВ – аргинин-вазопрессин; «+» — активирующие влияния; «-» — угнетающие влияния
уменьшение пролиферации лимфоцитов
уменьшение синтеза антител
угнетение активации нормальных киллеров
Патофизиология коматозных состояний
Определение понятия «кома»
Кома – тяжелое патологическое состоя-ние, характеризующееся потерей сознания, расстройством рефлекторной деятельности и глубокими нарушениями дыхания, кровообра-щения и обмена веществ.
* Основные виды комы
Диабетическая кома – развивается при нарушении диеты и инсулинотерапии у больных диабетом. Гипогликемическая (инсулиновая) кома – развивается при гипогликемии, связанной, как правило, с передозировкой инсулина. Печеночная кома – возникает при глубоком тотальном повреждении паренхимы печени. Почечная кома – развивается на заключительных этапах уремии. Малярийная кома – вызывается отравлением организма продуктами распада малярийных плазмодиев и эритроцитов. Аноксическая кома – развивается при резком снижении парциального
vunivere.ru
Экстремальные состояния организма. Стресс
На экстремальные ситуации — будь то холод, интоксикации, инфекционный процесс, травма, мышечная перегрузка или сильные эмоции — организм отвечает выработанной в процессе эволюции однотипной реакцией, которая носит название «стресс» (напряжение ). Этот термин был введен канадским патологом Гансом Селье.
Стресс сопровождается развитием общего адаптационного синдрома. Общий адаптационный синдром затрагивает весь организм и развивается по определенным закономерностям. В 1 стадии (тревоги) происходит мобилизация защитных сил организма. Во 2 стадии (резистентности) повышается устойчивость организма не только к стрессовому воздействию, но и к другим раздражителям. Резистентность носит общий перекрестный характер. Этим объясняется тот факт, что систематическое воздействие на организм умеренных стрессовых воздействий (холодный душ, дозированная гипоксия, не чрезмерные эмоциональные и физические нагрузки) поддерживает в организме готовность к адаптивным изменениям и обеспечивает адекватное реагирование. Убедительны итоги экспериментов, проведенных на крысах. Регистрировалась продолжительность жизни трех групп крыс: избавленных от стрессовых нагрузок (1 группа), подверженных умеренным (2 группа) и сильным стрессовым воздействиям (3 группа). Дольше всех жили животные 2 группы.
В развитии стадии тревоги и стадии резистентности повышается активность системы гипоталамус-гипофиз-надпочечники. В организме развиваются изменения, характерные для повышенного тонуса этой системы. Ценность этих изменений состоит в том, что они обеспечивают адаптацию организма в различных стрессовых ситуациях. Развивается гипергликемия вследствие стимуляции адреналином гидролиза гликогена до глюкозы, а также из-за увеличения синтеза глюкозы за счёт белков и жиров (действие гидрокортизона). В стадии резистентности происходит увеличение продукции гидрокортизона, что сопровождается гипертрофией коркового слоя надпочечников. Под влиянием стрессовых гормонов (адреналин, гидрокортизон) повышается реактивность сердечно-сосудистой системы. Это значит, что сосуды в условиях повышенного содержания гидрокортизона и адреналина готовы ответить сужением на малейший сосудосуживающий импульс.
Клинические и экспериментальные наблюдения приводят к выводу о том, что лица, перенесшие умеренные стрессорные нагрузки, могут приобрести «иммунитет» — устойчивость к последующим стрессовым влияниям. Имеет место «перекрёстный иммунитет» к стрессу, когда индивиды, адаптированные к умеренным дозированным стрессорным воздействиям (гипоксия, холод, голодание) приобретают устойчивость к последующим стрессорным воздействиям и, в частности, к психоэмоциональному стрессу (К.В. Судаков).
В стадии резистентности усиливается детоксикация эндогенных и экзогенных вредных веществ ферментными системами печени (в том числе лекарственных веществ). Например, экспериментально установлено, что при стрессе, вызываемом различными воздействиями (холод, хлороформ, облучение УФ-лучами, рентгеновскими лучами) ускоряется метаболизм лекарственных веществ. При исследовании механизма этого явления было показано, что введение кортикостерона увеличивает активность окислительных ферментов у крыс. Удаление у крыс надпочечников (адреналэктомия) или гипофиза (гипофизэктомия), напротив, снижает активность метаболизма. Одновременно с увеличением активности ферментных систем печени, осуществляющих детоксикацию эндогенных и экзогенных вредных веществ при стрессе, сопровождающемся увеличением продукции гормонов коры надпочечников, снижается активность иммунных реакций организма.
Однако это наблюдается во вторую фазу действия глюкокортикоидов. Вначале происходит быстрая мобилизация в кровь лейкоцитов из депо лёгких, печени, мышц, костного мозга и других органов. Основной прирост лейкоцитов обусловлен нейтрофилами — первой линией иммунной защиты организма. На первом этапе своего действия стрессорные гормоны (глюкокортикоиды) мобилизуют также лимфоциты и моноциты. Однако, в дальнейшем — при значительных стрессовых состояниях или при введении в организм глюкокортикоидов как лекарственных препаратов свыше 5 дней — уменьшается количество таких лейкоцитов, как базофилы, эозинофилы, лимфоциты, моноциты. Механизм этого явления пока не ясен. Что касается нейтрофилов, то глюкокортикоиды имеют к ним «благосклонное расположение». Под влиянием глюкокортикоидов «вялые» нейтрофилы становятся функционально активными. Интересно, что «вялый» нейтрофил недоношенного ребёнка имеет всего 2000 участков (рецепторов) для связывания глюкокортикоидов. По мере увеличения числа этих рецепторов увеличивается функциональная активность нейтрофила. У взрослого человека нейтрофил содержит свыше 4000 стероидных рецепторов (И.Ф. Алексеенко).
В стадии истощения, которая может наступить после стадии резистентности, происходит атрофия коркового слоя надпочечников с уменьшением их функционального резерва. Однако, чаще наблюдается выздоровление, то есть возвращение реактивности организма к уровню, близкому к исходному.
Стрессовые повреждения выступают как этиологический фактор многих болезней (главным образом, нервных, психических, сердечно-сосудистых, а также желудочно-кишечных). Поэтому защита организма от неумеренных стрессов представляет собой важный инструмент профилактики и лечения болезней. В качестве средств лекарственного воздействия применяются транквилизаторы, мишенью которых является лимбическая система мозга, где формируются эмоциональные реакции, а также другие успокаивающие средства.
Шок
Шок представляет собой тяжелый симптомокомплекс, возникающий в ответ на чрезвычайно сильный раздражитель и приводящий к резкому нарушению всех функций организма. Шок ставит организм на грань жизни и смерти. В зависимости от причины, вызвавшей шок, различают следующие его виды: гиповолемический, обусловленный уменьшением объёма циркулирующей крови, травматический, вызванный сильной болью, ожоговый, возникающий при обширных ожогах, кардиогенный, развивающийся при резком нарушении функций сердца, анафилактический, обусловленный попаданием в организм аллергена, гипогликемический, вызванный передозировкой инсулина или других гипогликемическнх средств, а также другие виды шока. Патофизиологическая картина шока может варьировать в зависимости от вида и тяжести повреждения, но имеются общие закономерности, позволяющие рассматривать шок как типовой патологический процесс. Общим, наиболее существенным, признаком для всех видов шока является остро наступающее уменьшение кровотока тканей с нарушением кровоснабжения клеток различных органов. В соответствии с этим главным признаком шок рассматривают как остро развивающуюся недостаточность кровоснабжения жизненно важных органов с последующей гипоксией тканей.
Шок проявляется следующими симптомами — холодная, влажная бледно-цианотичная или мраморная окраска кожи, конечности холодные, резко замедлен кровоток в ногтевом ложе. Температура тела падает. Пульс и дыхание частые и слабые. Артериальное давление резко снижено. Уменьшение кровотока в головном мозге проявляется затемнением сознания. Снижение почечного кровотока приводит к уменьшению количества выделяемой мочи. Уменьшение кровоснабжения печени сопровождается угнетением её функций, в том числе антитоксической.
Гиповолемический шок вызывается дефицитом объёма крови. Он может развиться вследствие кровопотери, из-за больших потерь плазмы (при ожогах, размозжении тканей) или как результат потери больших количеств жидкости и электролитов (перитонит, энтероколит и др.). При гиповолемии снижается объём циркулирующей крови и уменьшается обратный венозный возврат крови к сердцу. В результате уменьшается давление наполнения предсердий. Снижается ударный объём сердца и артериальное давление. В ответ на это повышается возбудимость симпатической нервной системы в возрастает выброс адреналина. Развивается симпато-адренергическая реакция. Она представляет собой попытку организма, несмотря на уменьшение ударного объёма сердца, удержать минутный объём сердца и артериальное давление в пределах нормы. Поддержание гомеостаза артериального давления является первоочередной задачей организма, так как жизнеспособность коры головного мозга сохраняется только в том случае, когда систолическое давление удерживается на уровне не ниже 80 мм. рт. ст. Эффект симпато-адреналовой системы реализуется через альфа- и бета-адренорецепторы. Увеличение частоты сердечных сокращений достигается путём стимуляции бета-адренорецепторов сердца, а сужение сосудов артериального русла и повышение артериального давления — через альфа-адренорецепторы сосудов. Сосуды различных органов суживаются неравномерно, что зависит от количества в них альфа-адренорецепторов. Особенно много их (и высока степень сужения сосудов) во внутренних органах, иннервируемых чревными нервами (печень, поджелудочная железа, кишечник), несколько меньше — в почках, коже и скелетных мышцах. Практически отсутствуют альфа-адренорецепторы в сердце и головном мозге. В разнородной реакции различных отделов сосудистой системы заложен свой смысл. При повышении тонуса симпато-адреналовой системы происходит перераспределение крови. За счёт уменьшения кровоснабжения тех органов, которые для выживания организма в остром периоде шока имеют меньшее значение, оставшаяся кровь направляется к центральным органам — сердцу и головному мозгу. Такое явление, при котором происходит перераспределение оставшегося количества циркулирующей крови в пользу жизненно важных органов обозначают централизацией кровообращения. К этой мере организм прибегает в экстремальных ситуациях. Симпато-адренергическую реакцию можно рассматривать как полезную в начальной фазе шока, так как она поддерживает на нормальном уровне кровоток в венечных сосудах сердца и сосудах головного мозга. Если же не происходит быстрой нормализации объёма циркулирующей крови и артериального давления, то в дальнейшем на передний план всё более выступают отрицательные качества централизации кровообращения. Например, при снижении систолического артериального давления ниже 10,4 кПа (60 мм рт. ст.) в почках прекращается кровоток и они перестают выполнять свои функции (шоковая почка). Существенно нарушаются функции других органов. Для коррекции этого состояния используют принцип фармакологической денервации — больному вводят альфа-адреноблокаторы , которые уменьшают эфферентные симпатические влияния, или ганглиоблокаторы, которые угнетают передачу эфферентных импульсов в ганглиях. Это позволяет нормализовать кровообращение в так называемых «периферических органах» и, тем самым, предотвратить необратимые изменения в них. Однако, эти лекарственные средства снижают артериальное давление и поэтому их можно применять лишь на том этапе лечения, когда артериальное давление приведено в норму.
Нарушения микроциркуляции при шоке происходят прежде всего в таких органах, как кожа, мышцы, почки, печень, поджелудочная железа, кишечник, то есть в периферических отделах сосудистого русла. При шоке развивается периферическая вазоконстрикция (сужение артериол и венул), как реакция на уменьшение минутного объёма сердца. Этот механизм, так же как и вышеописанный путь централизации кровообращения, направлен на перераспределение крови в пользу сердца и мозга. Однако и он оказывает пользу лишь на кратком временном интервале. При длительной периферической вазоконстрикции развивается гипоксия. Она приводит к расширению прекапиллярных сосудов. Однако, посткапиллярные сосуды остаются суженными. Проницаемость капилляров повышается. В результате жидкая часть крови выходит из капилляров в межклеточное пространство, возрастает вязкость крови и, за счёт этого, ещё больше замедляется кровоток. Создаются условия для развития грозного осложнения — образования в капиллярах микротромбов (диссеминированное внутрисосудистое свёртывание крови при шоке). Нарушение микроциркуляции характерно для всех форм шока, независимо от его причины. Развивается метаболический ацидоз, из-за гипоксии возрастает содержание молочной кислоты. Снижается энергообразование, вследствие дефицита ATФ нарушается функция натрий-калиевого насоса мембран клеток. Ионы натрия начинают проникать в клетку и, вслед за ними, по закону осмоса, в клетку устремляется вода. Клетка набухает. Из-за ацидоза высвобождаются ферменты лизосом, которые гидролизуют полимеры клетки и вызывают её гибель.
Таким образом, нарушение энергозависимых функций клеток является основным патогенетическим проявлением шока.
Определенные органы особенно чувствительны к шоку. Такие органы называются шоковыми. В первую очередь к ним относят лёгкие и почки, во вторую — печень. Циркуляторные нарушения, сопровождающие шок, приводят к уменьшению эластичности лёгкого, развивается удушье, снижается парциальное давление кислорода в артериальной крови. Снижается функция шоковой почки, что проявляется олигурией (уменьшением количества отделяемой мочи) и даже анурией (прекращением мочеотделения).
При шоке вводят в кровь плазмо- и кровезаменители, причём введение плазмы крови и плазмозамещающих растворов (полиглюкин, плазменный альбумин) в некоторых случаях предпочтительнее, чем введение цельной крови, так как они лучше воздействуют на микроциркуляцию. Разжижение крови улучшает капиллярный кровоток. Кроме того, некоторые плазмозаменители (например, декстран) обволакивают эритроциты и тромбоциты и, тем самым, препятствуют их агрегации и развитию синдрома диссемининированного внутрисосудистого свертывания крови. При развитии этого синдрома применяют препараты, вызывающие лизис тромбов (стрептаза). Использовать адреналин для повышения артериального давления опасно, так как он может усугубить централизацию кровообращения и нарушить микроциркуляцию. При длительной вазоконстрикции, наблюдаемой при шоке и ведущей к развитию тканевой гипоксии, прибегают к введению блокаторов альфа-адренорецепторов (фентоламин).
Кардиогенный шок наблюдается при снижении насосной функции сердца. Наиболее частой его причиной является инфаркт миокарда, реже — диффузный миокардит, тяжёлые нарушения ритма сердца, тромбоэмболия лёгочной артерии, а также тампонада сердца вследствие выпота или кровотечения в околосердечную сумку. Как и при гиповолемическом шоке основным патогенетическим звеном кардиогенного шока являются нарушения гемодинамики и явления, связанные с этим. Отличие состоит в том, что при кардиогенном шоке к сердцу поступает большое количество крови, что увеличивает нагрузку на повреждённый миокард.
Поэтому при этой форме шока опасно назначение средств, повышающих артериальное давление и стимулирующих работу сердца.
Травматический шок наступает при тяжелых травмах. В его развитии имеются существенные особенности, в частности, большое патогенетическое значение имеет мощный поток болевых импульсов, направляющихся в мозг из места повреждения. В результате возникает двухфазная реакция центральной нервной системы, которая определяет патогенез данного вида шока. Вначале формируется разлитое возбуждение нервной системы (эректильная фаза). Фаза возбуждения кратковременна. Она длится обычно 10-15 минут, реже — до 1 часа. При этом наблюдается двигательная и речевая возбудимость. У больного беспокойный взгляд, лицо бледное (в некоторых случаях красное), усилено потоотделение. Зрачки расширены, бурно реагируют на свет, пульс учащенный. В случаях, когда приспособительные реакции организма оказываются достаточными, может произойти нормализация возбудительного и тормозного процессов в центральной нервной системе с последующим исчезновением симптомов шока. Если же поток сверхсильных болевых импульсов не прекращается, то развивается вторая — торпидная (тормозная) фаза травматического шока. При этом наблюдается следующая клиническая картина. Развивается заторможенность психики — депрессивное состояние. Температура тела падает, пульс и дыхание частые и слабые. Артериальное давление резко снижено. Торпидная фаза продолжается дольше эректильной (несколько часов и даже суток). В фазной последовательности развития шока, которую установили и описали Н.И. Пирогов и Н.Н. Бурденко, можно проследить реализацию закономерностей уравнительной и парадоксальной фаз парабиоза, которые открыты Н.Е. Введенским.
Определенное значение в развитии травматического шока имеют продукты распада повреждённых тканей, обладающие токсическими свойствами и вызывающие «синдром раздавливания». В экспериментах на животных с перекрестным кровообращением при нанесении травмы одному животному, наблюдали развитие шока и у другого. В клинике иногда развивается шок при снятии наложенного жгута. В последние годы из повреждённых тканей выделены олигопептиды, которые ответственны за эти патофизиологические сдвиги.
Для лечения травматического шока проводят следующие меры:
1. Обезболивающие мероприятия. Применяют наркотические анальгетики, проводят новокаиновую блокаду. При размозжении тканей для предотвращения развития «синдрома раздавливания» повреждённую часть тела обкладывают льдом. При этом уменьшается всасывание в кровеносное русло токсических веществ из поврежденного участка тела.
2. Осуществляют меры, направленные на борьбу с расстройством кровообращения (переливание крови и противошоковых жидкостей под контролем кровяного давления). Если у больного систолическое давление ниже 60 мм рт. ст. или в результате струйного внутривенного переливания 500 мл крови систолическое артериальное давление не поднимается до 60-70 мм, то следует перейти к внутриартериальному вливанию крови или противошоковой жидкости под давлением в 200 мм рт. ст., дробными дозами по 40-50 мл через 3-5 мин, всего до 250 мл. Для стабилизации гемодинамики применяют также кровезаменители. Один из них — полиглюкин — является полимером глюкозы с молекулярной массой примерно 60000 дальтон. Молекулы полиглюкина не проходят через сосудистую стенку в ткани и не фильтруются в почках, поэтому препарат длительно циркулирует в крови, удерживая в ней воду и увеличивая её объём. В результате нормализуется артериальное и венозное давление.
3. Проводят мероприятия, направленные на борьбу с расстройством дыхания. Вводят в кровь препараты, стимулирующие дыхание (кордиамин, кофеин), по показаниям проводят искусственное дыхание.
4. Вводят средства, нормализующие обменные процессы (аскорбиновая кислота, никотиновая кислота, витамины комплекса В) и корригирующие кислотно-основное состояние организма (внутривенное введение 300-400 мл 4,5% раствора гидрокарбоната натрия).
helpiks.org
ЭКСТРЕМАЛЬНЫЕ СОСТОЯНИЯ
ЭКСТРЕМАЛЬНЫЕ СОСТОЯНИЯ (латинский extremus крайний) — состояния организма, характеризующиеся чрезмерным напряжением или истощением приспособительных механизмов.
Общепринятого определения понятия «экстремальные состояния», объективных критериев их оценки и классификации не существует. Экстремальные состояния могут возникать первично при воздействии на организм разнообразных чрезвычайных раздражителей (например, травм, экзогенных интоксикаций, резких колебаний температуры воздуха и концентрации кислорода, гипокинезии, физических перегрузок) или явиться результатом неблагоприятного течения имеющегося заболевания (напр., недостаточности кровообращения, дыхательной, почечной или печеночной недостаточности, анемии и др.).
В основе развития экстремальных состояний могут лежать различные патофизиологические механизмы. Организм может подвергаться воздействию одного или нескольких экстремальных факторов (например, интенсивных физических нагрузок в условиях высокогорья и пустынь, при космических полетах, глубоководных работах и т. д.), но возникающее при этом максимальное напряжение адаптивных механизмов предотвращает угрожающие жизни отклонения параметров гомеостаза. Такие состояния максимального напряжения приспособительных систем организма без видимых нарушений жизненно важных функций нередко относят к экстремальным, хотя в подобных случаях старее можно говорить об экстремальных условиях существования. Крайнее напряжение физиологических систем, ответственных за экстренную адаптацию организма, характерно, например, для первой стадии (реакция напряжения) стресса (см.) при переходе ее в стадию истощения. В других случаях при действии на организм чрезвычайных факторов предельное напряжение приспособительных реакций приводит к нарушениям в других системах. Например, при массивной кровопотере (см.) перераспределение кровотока для обеспечения удовлетворительных параметров центральной гемодинамики сопровождается резким ограничением локального почечного кровотока и может вызвать тяжелую недостаточность выделительной функции почек.
Когда патогенность чрезвычайного раздражителя превышает предельные возможности адаптации организма (см. Адаптация), возникают грубые нарушения жизненно важных функций и непосредственная угроза гибели. В таких случаях может возникнуть своеобразная форма экстремальных состояний — так называемые претерминальные и терминальные состояния (см.).
Многие формы экстремальных состояний обратимы, в то время как терминальные состояния без специальной экстренной помощи заканчиваются гибелью организма. При экстремальных состояниях обычно достаточно определенно проявляются свойства вызвавшего их патогенного фактора и специфических механизмов развития (например, при травматическом и анафилактическом шоке, постгеморрагическом коллапсе); устранение патогенного фактора и блокада основных патогенетических механизмов (в частности, болевой афферентации, токсемии) могут оказаться эффективными. Однако в терминальных состояниях значение природы этиологического фактора и специфических механизмов развития патологии относительно невелико. В этих случаях жизнь больного непосредственно зависит от состояния дыхания и кровообращения, а также от времени, прошедшего после их прекращения.
Наиболее важными и часто встречающимися экстремальными состояниями являются коллапс (см.), шок (см.) и кома (см.). Эти состояния классифицируют в зависимости от вызвавшего их этиологического фактора или лежащих в основе их развития патогенетических механизмов. Практически любой патогенный фактор, вызывающий серьезные нарушения жизнедеятельности, может при наличии соответствующих условий привести к возникновению коллапса, шока или комы.
Некоторые экстремальные состояния могут существовать как самостоятельно, так и входить в качестве компонента в более сложные патологические состояния организма (например, коллапс может возникать при любых шоковых и коматозных состояниях). В таких случаях обычно называют форму более общего экстремального состояния — в приведенных примерах, соответственно, шок или кома. Кроме этого, одно экстремальное состояние, например стресс в процессе развития (от реакции напряжения к стадии истощения), может переходить в другое экстремальное состояние, например коллапс при гипокинетическом, холодовом или болевом стрессе.
Экстремальным состояниям свойственны закономерно возникающие адаптивные реакции. В начальных стадиях развития экстремальных состояний адаптация организма к патогенным воздействиям включает механизмы, реализующиеся на различных уровнях организации. В процессе развития экстремальных состояний существенное значение имеет активация симпатоадреналовой и гипофизарно-надпочечниковой систем, характерная для стресса. По мере углубления тяжести состояния происходит сужение диапазона приспособительных реакций, распад функциональных систем, обеспечивающих сложные адаптивные поведенческие акты и тонкую регуляцию локомоторных и вегетативных функций. Одним из механизмов перехода организма на экстремальные формы адаптации является прогрессирующее отключение центральных нейронов от разнообразной афферентации, обеспечивающей формирование сложных функциональных систем (см.). Сохраняется реализация лишь минимума афферентных сигналов (в основном интероцептивных), необходимых для осуществления элементарных форм дыхания, кровообращения и ряда других жизненно важных функций; регуляция процессов жизнедеятельности в основном переходит на метаболический уровень. В этой стадии, как правило, имеются выраженные нарушения всех физиологических функций.
Характерным для патогенеза экстремальных состояний является развитие цепных патологических реакций, усугубляющих возникновение расстройств в организме (см. Circulus vitiosus). Так, при шоке нарушение деятельности центральной нервной системы приводит к нарушениям регуляции кровообращения и дыхания и развитию гипоксии (см.), которая, в свою очередь, углубляет расстройства нервной регуляции и недостаточность кровообращения и дыхания. При сосудистом коллапсе происходит депонирование крови в органах брюшной полости и уменьшение объема циркулирующей крови; вследствие этого снижаются венозный возврат крови к сердцу и сердечный выброс, что ведет к дальнейшему уменьшению объема циркулирующей крови и утяжелению общего состояния. Подобные «порочные круги» возникают на уровнях разных систем организма и при неблагоприятном течении патологического процесса определяют тенденцию экстремальных состояний к «самоуглублению» и переходу в терминальное состояние даже после устранения первичного патогенетического фактора.
При всех экстремальных состояниях наблюдаются идентичные или сходные расстройства обмена веществ и физиологических функций, прежде всего гипоксия. В ряде случаев именно гипоксия служит инициальным этиологическим фактором, приводящим к развитию экстремальных состояний. Различают, например, гипоксическую кому, вызванную недостаточным поступлением кислорода извне при резких расстройствах кровообращения и нарушением переноса кислорода кровью при тяжелых анемиях и изменениях свойств гемоглобина, а также при первичных нарушениях утилизации кислорода в тканях. Различные формы первично возникающей гипоксии могут привести также к развитию коллапса. Однако чаще всего гипоксия возникает вторично при развитии экстремального состояния, вызванного каким-либо другим воздействием, приобретая при этом роль самостоятельного, а нередко и решающего патогенетического фактора. При этом гипоксия носит смешанный характер и обусловлена различными комбинациями расстройств дыхания, кровообращения. условий оксигенации гемоглобина в легких и его дезоксигенации в тканях. Возникновению вторичной гипоксии при экстремальных состояниях способствует повреждение мембранных структур, обеспечивающих пассивный и активный транспорт субстратов и пространственную упорядоченность ферментов, необходимых для нормального биологического окисления (см. Мембраны биологические).
Экстремальные состояния обычно сопровождаются усиленным высвобождением и образованием гистамина (см.), серотонина (см.), кининов (см.), лизосомальных ферментов (см. Лизосомы) и других физиологически активных веществ; часто развивается диспротеинемия, накапливаются продукты денатурации белка и распада клеток. Указанные нарушения в значительной мере характерны для всех экстремальных состояний, однако их выраженность и соотношение могут существенно различаться как при разных видах экстремальных состояний, так и в пределах каждого вида. Так, при многих видах коллапса, при ожоговом шоке и дегидратационной коме происходит обезвоживание организма, сгущение крови и повышение показателя гематокрита (см. Гематокритное число). В то же время при постгеморрагическом коллапсе за счет перехода в кровяное русло тканевой жидкости и почечной задержки воды наблюдаются разжижение крови и снижение гематокритного числа.
Экстремальным состояниям свойственны расстройства микроциркуляции: нарушение перфузии микрососудов, расширение капилляров, прекапиллярных сфинктеров, венул и снижение их чувствительности к вазон рессорным влияниям. увеличение проницаемости сосудистых стенок и их структурные нарушения вплоть до некробиоза. Возникают патологическая агрегация эритроцитов, «сладж-синдром», (см. Легкие, патологическая анатомия), гиперкоагуляция крови, диссеминированное внутрисосудистое свертывание крови и микротромбоз сосудов (см. Микроциркуляция).
Расстройства микроциркуляции в легких (так называемое «шоковое легкое») могут приводить к тяжелым нарушениям их газообменной функции (см. Легкие), аналогичные изменения в почках («шоковая почка») — к почечной недостаточности (см.). Нарушения системы микроциркуляции в печени и мозге могут вызвать печеночную недостаточность (см.) и резкие расстройства нервной деятельности.
При всех экстремальных состояниях наблюдаются также нарушения системной гемодинамики (см.), характеризующиеся уменьшением объема циркулирующей крови и скорости кровотока, увеличением депонирования крови, снижением венозного возврата крови к сердцу, падением тонуса артериол и вен вплоть до их пареза и уменьшением общего периферического сопротивления сосудистого русла. Со стороны сердца часто отмечаются тахикардия, различные формы аритмий, недостаточность коронарного кровотока, уменьшение сердечного выброса и другие признаки, характерные для сердечной недостаточности (см.).
Отдельные гемодинамические проявления экстремальных состояний могут иметь различную выраженность и последовательность развития. Так, для любого шока в начальной фазе характерно наличие артериальной гипертензии, для постгеморрагического коллапса — этап перераспределения кровотока (так называемая централизация кровообращения); при кардиогенном коллапсе первично возникает резкое уменьшение ударного объема сердца, что может привести, несмотря на тахикардию, к падению системного АД, и значительное повышение общего периферического сопротивления сосудов.
Нарушения внешнего дыхания при экстремальных состояниях проявляются разнообразными изменениями его глубины и частоты, ритма дыхательных движений, соотношения фаз вдоха и выдоха, а также периодическими феноменами — так называемым волнообразным дыханием, периодическим дыханием типа Биота (см. Биотовское дыхание) и Чейна — Стокса (см. Чейна — Стокса дыхание), дыханием типа Куссмауля (см. Куссмауля дыхание), длительными инспираторными задержками («апнейзис») и другими патолологическими формами дыхания.
Нарушения функций нервной системы, особенно на ранних стадиях развития экстремальных состояний, различны. Так, для большинства видов шока после периода общего возбуждения в эректильной фазе характерно своеобразное сочетание сохраненного сознания с общей глубокой заторможенностью в торпидной фазе. Сознание утрачивается лишь в конце этой фазы при переходе в терминальное состояние. При коллапсе сознание может быть сохранено в течение длительного времени; часто отмечаются чувства тоски, угнетенности и безучастности к окружающему. Развитие коматозных состояний обычно начинается с появления нарастающей сонливости, больные с трудом вступают в адекватный контакт, сознание частично помрачено. При углублении комы происходит полная потеря сознания и возникает тотальная а рефлексия по отношению к экстероцептивным раздражениям.
Экстремальные состояния требуют неотложных и эффективных лечебных мероприятий. Терапия различных экстремальных состояний во многом сходна и определяется общностью патогенетических механизмов. Однако в каждом конкретном случае необходимо учитывать этиологию возникшего экстремального состояния, особенности его патогенеза и характер сопутствующих нарушений.
В зависимости от состояния больного первые неотложные меры должны быть направлены на ослабление тяжести гипоксии, а также на устранение непосредственно угрожающих жизни расстройств физиологических функций. По возможности в первую очередь устраняется причина, вызвавшая развитие экстремального состояния, затем выявляются и прерываются «порочные круги», способствующие усугублению тяжести экстремальных состояний и переходу их в терминальное состояние. Наряду с мерами общего характера решающее значение приобретает вмешательство в специфические патогенетические механизмы отдельных форм экстремальных состояний.
Библиогр.: Багров Я. Ю. Водно-солевой гомеостаз при недостаточности кровообращения, Л., 1984; Боголепов Н. К. Коматозные состояния, М., 1962; Бунятян А. А., Рябов Г.А. и Маневич А. 3. Анестезиология и реаниматология, М., 1984; Крыжановский Г. Н. Детерминантные структуры в патологии нервной системы. М., 1980; Кулагин В. К. Патологическая физиология травмы и шока, Л., 1978; Лосев Н. И., Xитров Н. К. и Грачев С. В. Патофизиология гипоксических состояний и адаптация организма к гипоксии, М., 1982; Меерсон Ф. 3. Адаптация, стресс и профилактика, М., 1981; Молчанов Н. С. Гипотонические состояния, Л., 1962; Неговский В. А. и др. Основы реаниматологии, М., 1975; Патологическая физиология экстремальных состояний, иод ред. П. Д. Горизонтова и Н. Н. Сиротинина. М., 1973; Руководство по кардиологии, под ред. Е. И. Чазова, т. 3, М., 1982; Селье Г. Очерки об адаптационном синдроме, пер. с англ., М., 1960.
Н. И. Лосей; С. В. Грачев, Н. К. Хитров.
xn--90aw5c.xn--c1avg